新聞中心
阿爾茨海默病(AD)是一種進(jìn)行性神經(jīng)退行性疾病,其特征為 β 淀粉樣蛋白(Aβ)斑塊沉積、 tau 蛋白過度磷酸化以及神經(jīng)炎癥。脈絡(luò)叢(ChP)作為血 - 腦脊液屏障,在應(yīng)激免疫反應(yīng)和腦內(nèi)穩(wěn)態(tài)維持中發(fā)揮關(guān)鍵作用。然而,脈絡(luò)叢在 AD 進(jìn)展中的細(xì)胞與分子機(jī)制仍未被充分闡明。

2025 年 5 月 31 日,中國科學(xué)院昆明動(dòng)物研究所姚永剛教授團(tuán)隊(duì)在 Molecular Neurodegeneration發(fā)表了題為:Early transcriptional and cellular abnormalities in choroid plexus of a mouse model of Alzheimer’s disease的研究論文。描繪了 AD 小鼠模型中脈絡(luò)叢的早期轉(zhuǎn)錄和細(xì)胞異常,為腦血管系統(tǒng)在 AD 病理生物學(xué)中的作用提供了新的見解。
實(shí)驗(yàn)構(gòu)建了單細(xì)胞分辨率下的脈絡(luò)叢綜合細(xì)胞圖譜,并在雄性小鼠中鑒定出六種主要細(xì)胞類型和免疫亞群。與野生型(WT)小鼠相比,APP/PS1 小鼠中大多數(shù)失調(diào)基因存在于上皮細(xì)胞中,且這些基因大多屬于參與線粒體呼吸體組裝、纖毛組織和屏障完整性的下調(diào)模塊。上皮屏障的破壞導(dǎo)致 APP/PS1 小鼠中巨噬細(xì)胞遷移抑制因子(MIF)分泌下調(diào),進(jìn)而引發(fā)巨噬細(xì)胞活化并增強(qiáng) Aβ 吞噬作用。與此同時(shí),與 WT 對照組相比,APP/PS1 小鼠中巨噬細(xì)胞及其他脈絡(luò)叢細(xì)胞分泌的配體(如 APOE)促進(jìn)脂質(zhì)進(jìn)入室管膜細(xì)胞,導(dǎo)致脂質(zhì)積累并激活腦實(shí)質(zhì)中的小膠質(zhì)細(xì)胞。
通過 TissueFAXS Spectra 系統(tǒng)結(jié)合 StrataQuest 分析平臺(tái),實(shí)現(xiàn)了多重免疫熒光樣本成像及定量分析。該技術(shù)識(shí)別了多種標(biāo)記蛋白的空間分布,并對細(xì)胞類型、蛋白表達(dá)強(qiáng)度及細(xì)胞間相互作用進(jìn)行精準(zhǔn)定量。
研究中通過該技術(shù)驗(yàn)證了脈絡(luò)叢(ChP)中不同細(xì)胞類型的標(biāo)記蛋白表達(dá)(如上皮細(xì)胞標(biāo)記 OTX2、內(nèi)皮細(xì)胞標(biāo)記 PECAM1 等),并量化了 AD 模型中細(xì)胞結(jié)構(gòu)和功能的異常變化,為分子機(jī)制研究提供了形態(tài)學(xué)佐證。
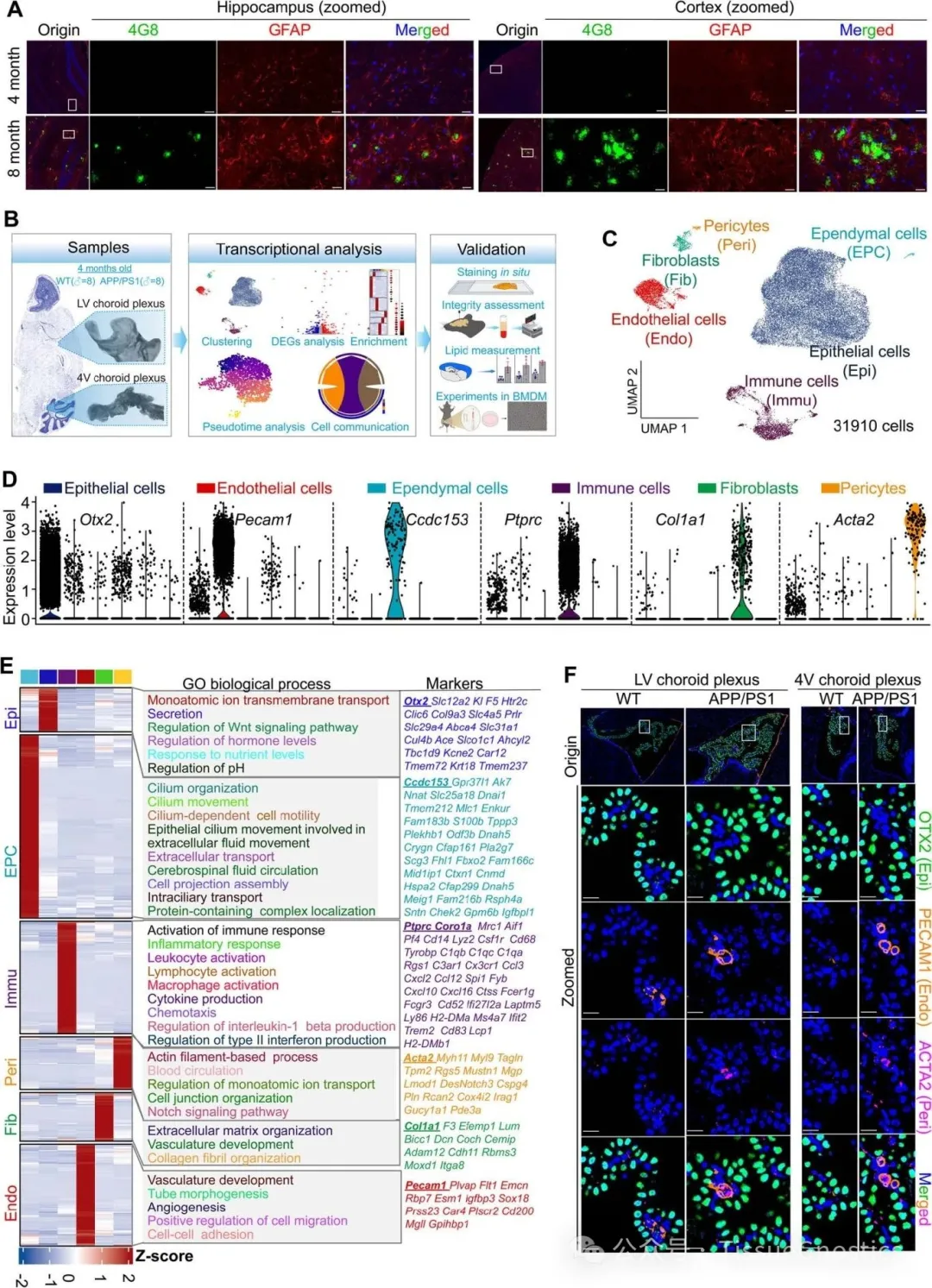
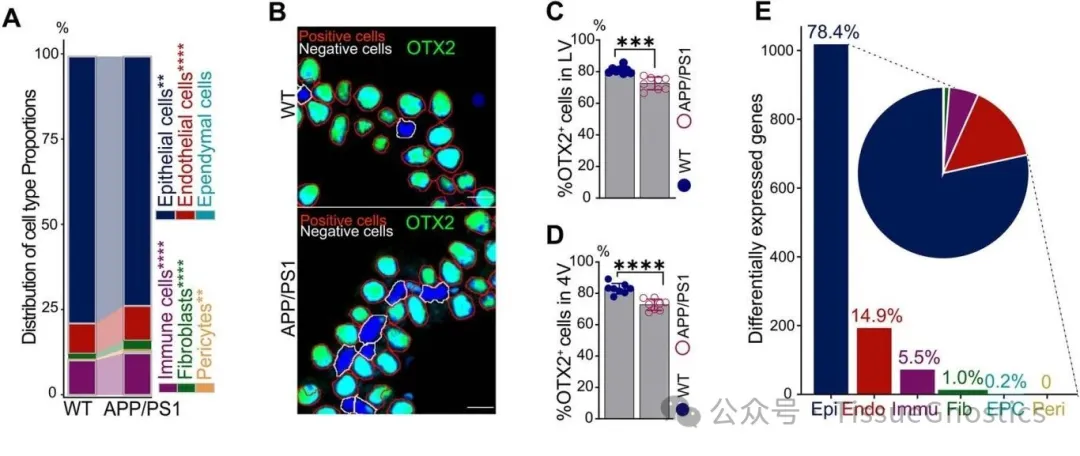
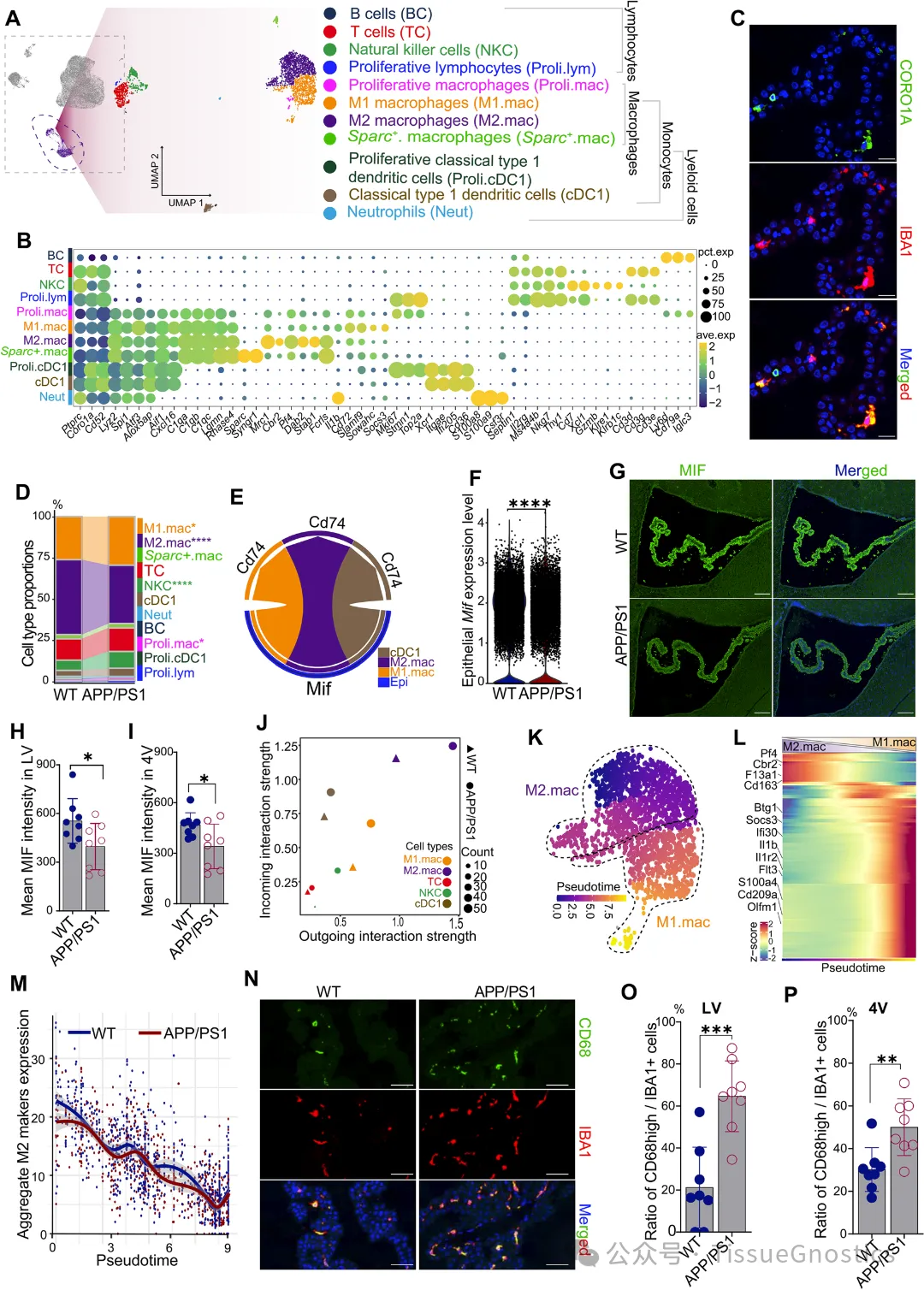
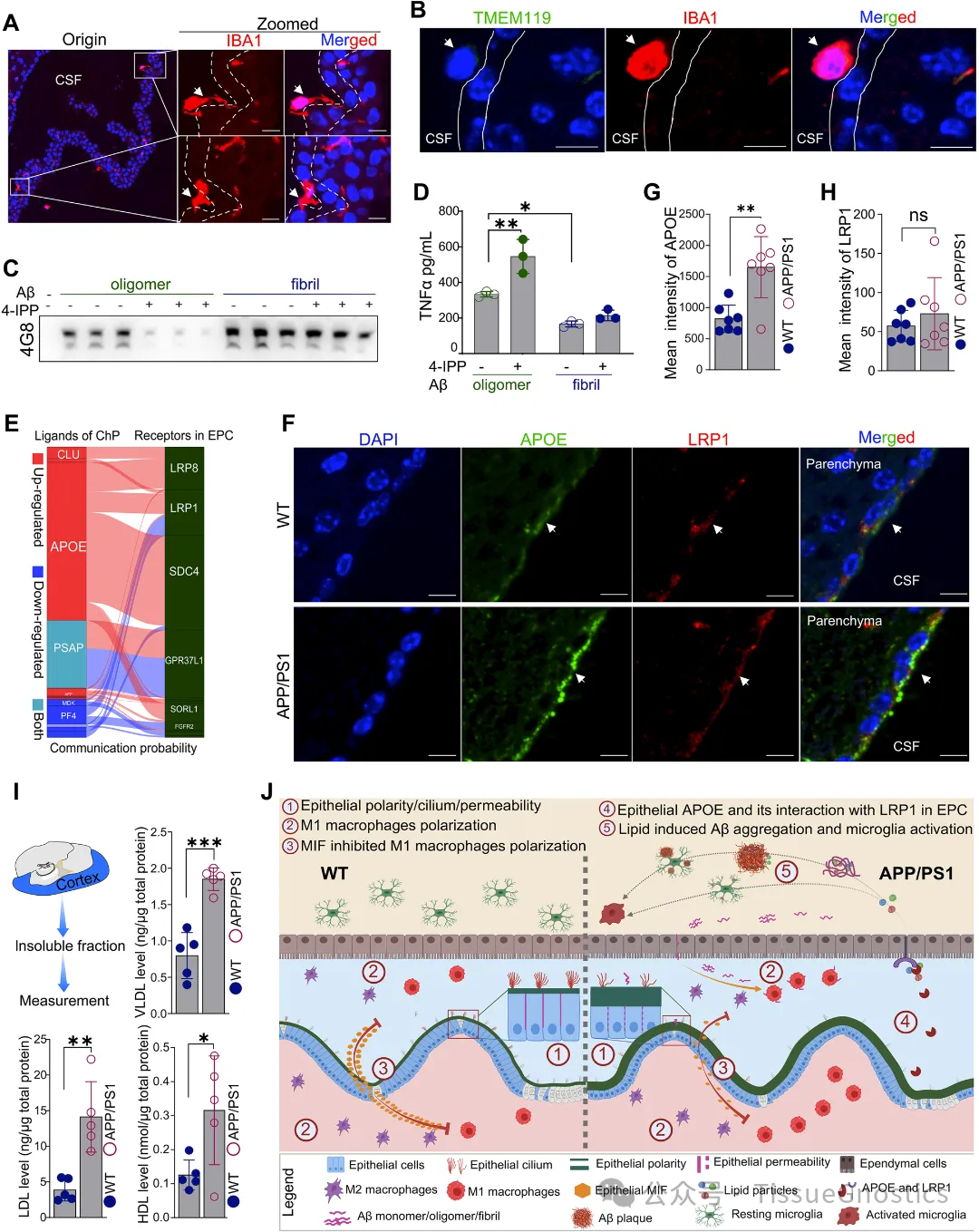
Figure 1F 多色免疫熒光驗(yàn)證細(xì)胞類型標(biāo)記 TissueGnostics 的成像系統(tǒng)結(jié)合多重免疫熒光染色,對 ChP 中的上皮細(xì)胞(OTX2)、內(nèi)皮細(xì)胞(PECAM1)和周細(xì)胞(ACTA2)進(jìn)行共定位染色。綠色熒光(OTX2)標(biāo)記上皮細(xì)胞,紅色熒光(ACTA2)標(biāo)記周細(xì)胞,紫色熒光(CD31/PECAM1)標(biāo)記內(nèi)皮細(xì)胞,藍(lán)色(DAPI)標(biāo)記細(xì)胞核。 通過 StrataQuest 平臺(tái)自動(dòng)識(shí)別不同細(xì)胞類型的空間分布,驗(yàn)證了單細(xì)胞測序中鑒定的 6 種主要細(xì)胞類型的存在及定位。確認(rèn)了 ChP 細(xì)胞組成的分子標(biāo)記可靠性,為后續(xù) AD 模型中細(xì)胞比例變化(如上皮細(xì)胞減少)的研究奠定基礎(chǔ)。 Figure 2 上皮細(xì)胞定量分析 B-D通過 OTX2 熒光信號(hào)自動(dòng)區(qū)分上皮細(xì)胞(紅色框)與非上皮細(xì)胞(白色框),并量化側(cè)腦室(LV)和第四腦室(4V)中 OTX2 陽性細(xì)胞的比例。 免疫熒光染色顯示 APP/PS1 小鼠 ChP 中 OTX2 陽性上皮細(xì)胞數(shù)量顯著減少,與單細(xì)胞測序中 “上皮細(xì)胞比例降低” 的結(jié)果一致。從形態(tài)學(xué)角度驗(yàn)證了 AD 模型中 ChP 上皮細(xì)胞的數(shù)量減少,為 “上皮細(xì)胞功能異常是 AD 早期病理關(guān)鍵” 的假設(shè)提供了證據(jù)。 Figure 3 ChP 上皮細(xì)胞結(jié)構(gòu)損傷驗(yàn)證 A-I 對纖毛標(biāo)記(ARL13B、γ-tubulin)、線粒體復(fù)合物 UQCRB 及上皮極性蛋白 EZR 的熒光信號(hào)進(jìn)行高分辨率成像,并分析信號(hào)強(qiáng)度與分布。 纖毛結(jié)構(gòu):APP/PS1 小鼠 ChP 上皮細(xì)胞中 ARL13B(綠色)和 γ-tubulin(紅色)標(biāo)記的纖毛密度降低,側(cè)腦室與第四腦室的定量結(jié)果均顯示顯著差異(P<0.05)。 線粒體功能:UQCRB(綠色)表達(dá)減少,提示線粒體呼吸體組裝受損。 上皮極性:EZR(綠色)在 APP/PS1 小鼠中從頂端膜(CSF 側(cè))向基底膜分布異常,通過二維方差分析(ANOVA)量化其分布偏移,證明上皮屏障完整性破壞。 結(jié)合單細(xì)胞測序中 “線粒體功能基因下調(diào)” 的發(fā)現(xiàn),從形態(tài)學(xué)證實(shí) AD 早期 ChP 上皮細(xì)胞的纖毛結(jié)構(gòu)異常和極性喪失,解釋了血 - 腦脊液屏障(BCSFB)通透性增加的機(jī)制。 Figure 4 免疫細(xì)胞活化與定位分析 C,N-P 對免疫細(xì)胞標(biāo)記(CORO1A、IBA1、CD68)進(jìn)行熒光成像,量化 APP/PS1 小鼠 ChP 中 M1 型巨噬細(xì)胞(CD68hi IBA1+)的比例及分布。 CORO1A(綠色)標(biāo)記免疫細(xì)胞,IBA1(紅色)標(biāo)記單核細(xì)胞,顯示 APP/PS1 小鼠中促炎型 M1 巨噬細(xì)胞數(shù)量增加。 CD68(綠色)作為 M1 巨噬細(xì)胞的經(jīng)典標(biāo)記,其熒光強(qiáng)度在 APP/PS1 小鼠 ChP 中顯著升高,側(cè)腦室與第四腦室的定量結(jié)果支持 “M1 極化增強(qiáng)” 的結(jié)論。 結(jié)合單細(xì)胞測序中 “免疫細(xì)胞轉(zhuǎn)錄譜激活” 的發(fā)現(xiàn),從形態(tài)學(xué)驗(yàn)證了 AD 早期 ChP 中巨噬細(xì)胞向促炎表型(M1)的極化,為 “上皮細(xì)胞 MIF 下調(diào)驅(qū)動(dòng)免疫失衡” 的機(jī)制提供了證據(jù)。 Figure 5 A-B F-H 巨噬細(xì)胞遷移與 APOE-LRP1 互作分析 巨噬細(xì)胞(IBA1+)在 ChP 與腦脊液(CSF)界面的遷移,并量化 APOE(綠色)與其受體 LRP1(紅色)在室管膜細(xì)胞中的共定位。 IBA1 + 單核細(xì)胞在 APP/PS1 小鼠 ChP 中向 CSF 和室管膜細(xì)胞(白色虛線)遷移,提示免疫細(xì)胞跨屏障浸潤。 APOE 與 LRP1 在室管膜細(xì)胞中 co-staining,APP/PS1 小鼠中 APOE 表達(dá)升高而 LRP1 無顯著變化,結(jié)合單細(xì)胞測序中 “APOE 分泌增加” 的結(jié)果,支持 “ChP 來源 APOE 通過 LRP1 介導(dǎo)脂質(zhì)運(yùn)輸” 的假設(shè)。 從空間分布角度驗(yàn)證了 ChP - 室管膜細(xì)胞的信號(hào)交互,為 “APOE 誘導(dǎo)腦實(shí)質(zhì)脂質(zhì)積累與小膠質(zhì)細(xì)胞激活” 的病理鏈條提供了形態(tài)學(xué)證據(jù)。